Le glucagon est une hormone peptidique, produite par les cellules alpha du pancréas. Le glucagon augmente la concentration de glucose et d’acides gras dans le sang et est considéré comme la principale hormone catabolique du corps. Le glucagon est également utilisé comme médicament pour traiter un certain nombre de problèmes de santé. L’effet du glucagon est opposé à celui de l’insuline, qui abaisse le glucose extracellulaire. Le glucagon est produit à partir du proglucagon, codé par le gène GCG.
Le pancréas libère du glucagon lorsque la quantité de glucose dans le sang est trop faible. Le glucagon provoque la glycogénolyse du foie : la conversion du glycogène stocké en glucose, qui est libéré dans la circulation sanguine. Des niveaux élevés de glucose dans le sang, d’autre part, stimulent la libération d’insuline. L’insuline permet au glucose d’être absorbé et utilisé par les tissus insulino-dépendants. Ainsi, le glucagon et l’insuline font partie d’un système de rétroaction qui maintient la glycémie stable. Le glucagon augmente la dépense énergétique et est élevé dans des conditions de stress. Le glucagon appartient à la famille des hormones sécrétines.
Fonction du glucagon
Le glucagon élève généralement la concentration de glucose dans le sang en favorisant la néoglucogenèse et la glycogénolyse. Le glucagon diminue également la synthèse des acides gras dans le tissu adipeux et le foie. Le glucagon favorise la lipolyse dans ces tissus, ce qui les amène à libérer des acides gras dans la circulation où ils peuvent être catabolisés pour générer de l’énergie dans des tissus tels que le muscle squelettique lorsque cela est nécessaire.
Le glucose est stocké dans le foie sous forme de glycogène polysaccharidique, qui est un glucane (un polymère composé de molécules de glucose). Les cellules hépatiques (hépatocytes) possèdent des récepteurs du glucagon. Lorsque le glucagon se lie aux récepteurs du glucagon, les cellules hépatiques convertissent le glycogène en molécules de glucose individuelles et les libèrent dans la circulation sanguine, dans un processus connu sous le nom de glycogénolyse. Lorsque le stockage du glucose s’épuise, le glucagon encourage alors le foie et les reins à synthétiser du glucose supplémentaire par néoglucogenèse. Le glucagon désactive la glycolyse dans le foie, provoquant le transfert des intermédiaires glycolytiques vers la néoglucogenèse.
Le glucagon régule également le taux de production de glucose par lipolyse. Le glucagon induit la lipolyse chez l’homme dans des conditions de suppression de l’insuline (comme le diabète sucré de type 1).
La production de glucagon semble dépendre du système nerveux central par des voies encore à définir. Chez les animaux invertébrés, il a été rapporté que l’élimination du pédoncule oculaire affecte la production de glucagon. L’excision du pédoncule oculaire chez les jeunes écrevisses produit une hyperglycémie induite par le glucagon.
Mécanisme d’action du glucagon
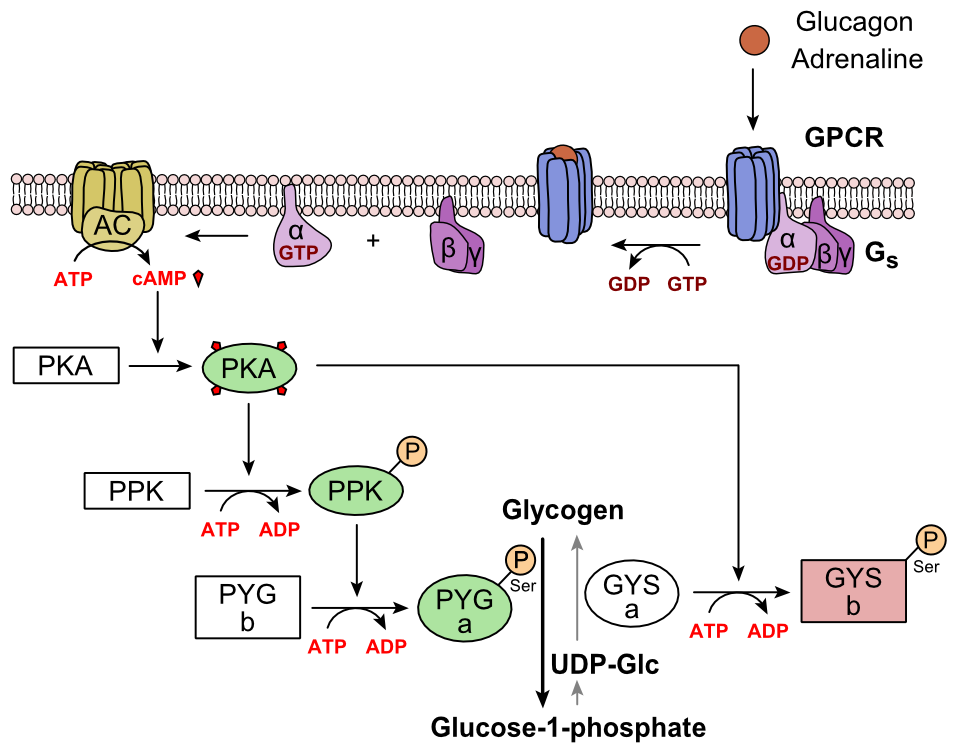
Le glucagon se lie au récepteur du glucagon, un récepteur couplé à la protéine G, situé dans la membrane plasmique de la cellule. Le changement de conformation du récepteur active les protéines G, une protéine hétérotrimérique avec les sous-unités , et . Lorsque la protéine G interagit avec le récepteur, elle subit un changement de conformation qui entraîne le remplacement de la molécule GDP qui était liée à la sous-unité par une molécule GTP. Cette substitution entraîne la libération de la sous-unité des sous-unités β et . La sous-unité alpha active spécifiquement l’enzyme suivante dans la cascade, l’adénylate cyclase.
L’adénylate cyclase fabrique l’adénosine monophosphate cyclique (AMP cyclique ou AMPc), qui active la protéine kinase A (protéine kinase dépendante de l’AMPc). Cette enzyme, à son tour, active la phosphorylase kinase, qui phosphoryle ensuite la glycogène phosphorylase b (PYG b), la convertissant en la forme active appelée phosphorylase a (PYG a). La phosphorylase a est l’enzyme responsable de la libération du glucose 1-phosphate à partir des polymères de glycogène.
Un exemple de la voie serait lorsque le glucagon se lie à une protéine transmembranaire. Les protéines transmembranaires interagissent avec Gɑβ𝛾. Gɑ se sépare de Gβ𝛾 et interagit avec la protéine transmembranaire adénylyl cyclase. L’adénylyl cyclase catalyse la conversion de l’ATP en AMPc. L’AMPc se lie à la protéine kinase A et le complexe phosphoryle la phosphorylase kinase. La phosphorylase kinase phosphorylée phosphoryle la phosphorylase. La phosphorylase phosphorylée extrait les unités glucose du glycogène sous forme de glucose 1-phosphate.
De plus, le contrôle coordonné de la glycolyse et de la néoglucogenèse dans le foie est ajusté par l’état de phosphorylation des enzymes qui catalysent la formation d’un puissant activateur de la glycolyse appelé fructose 2,6-bisphosphate. L’enzyme protéine kinase A (PKA) qui a été stimulée par la cascade initiée par le glucagon va également phosphoryler un seul résidu sérine de la chaîne polypeptidique bifonctionnelle contenant à la fois les enzymes fructose 2,6-bisphosphatase et phosphofructokinase-2. Cette phosphorylation covalente initiée par le glucagon active la première et inhibe la seconde. Cela régule la réaction catalysant le fructose 2,6-bisphosphate (un puissant activateur de la phosphofructokinase-1, l’enzyme qui est la principale étape régulatrice de la glycolyse) en ralentissant la vitesse de sa formation, inhibant ainsi le flux de la voie de la glycolyse et permettant la gluconéogenèse à prédominer. Ce processus est réversible en l’absence de glucagon (et donc en présence d’insuline).
La stimulation par le glucagon de la PKA inactive également l’enzyme glycolytique pyruvate kinase dans les hépatocytes.
Physiologie
Production de glucagon
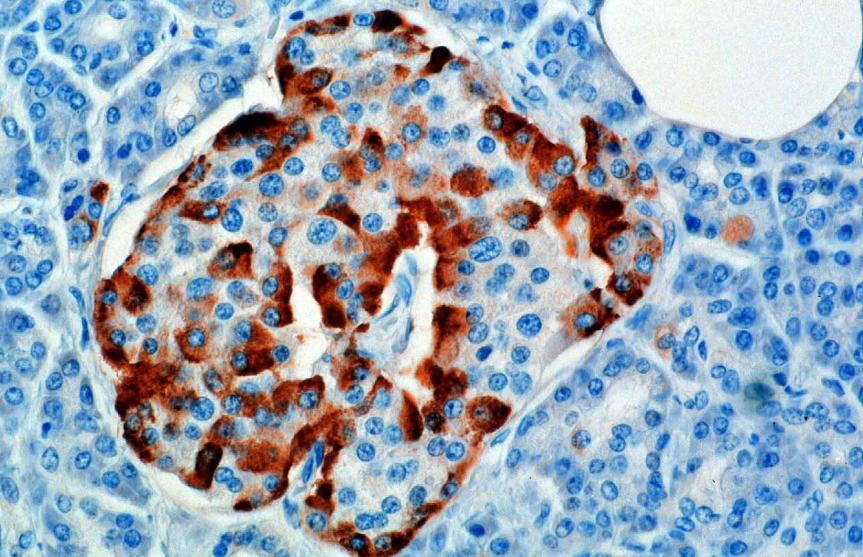
L’hormone est synthétisée et sécrétée par les cellules alpha (cellules α) des îlots de Langerhans, situées dans la partie endocrine du pancréas. La production, qui est par ailleurs libre, est supprimée/régulée par l’amyline, une hormone peptidique co-sécrétée avec l’insuline par les cellules pan pancréatiques. À mesure que les niveaux de glucose plasmatique diminuent, la réduction subséquente de la sécrétion d’amyline atténue sa suppression des cellules α, permettant la sécrétion de glucagon.
Chez les rongeurs, les cellules alpha sont situées sur le bord extérieur de l’îlot. La structure des îlots humains est beaucoup moins ségréguée et les cellules alpha sont réparties dans tout l’îlot à proximité immédiate des cellules bêta. Le glucagon est également produit par les cellules alpha de l’estomac.
Des recherches récentes ont démontré que la production de glucagon peut également avoir lieu en dehors du pancréas, l’intestin étant le site le plus probable de la synthèse extrapancréatique du glucagon.
Régulation du glucagon
La sécrétion de glucagon est stimulée par :
- Hypoglycémie
- Épinéphrine (via les récepteurs adrénergiques β2, α2 et 1)
- Arginine
- Alanine (souvent de la transamination pyruvate/glutamate d’origine musculaire
- Acétylcholine
- Cholécystokinine
- Polypeptide inhibiteur gastrique
La sécrétion de glucagon est inhibée par :
- Somatostatine
- Amyline
- Insuline (via GABA)
- Hétérodimère de récepteur PPARy/rétinoïde X.
- Augmentation des acides gras libres et des acides céto dans le sang.
- Augmentation de la production d’urée
- Peptide de type glucagon-1
Structure du glucagon
Le glucagon est un polypeptide de 29 acides aminés. Sa structure principale chez l’homme est : NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp -Leu-Met-Asn-Thr-COOH.
Le polypeptide a une masse moléculaire de 3485 daltons. Le glucagon est une hormone peptidique (non stéroïdienne).
Le glucagon est généré à partir du clivage du proglucagon par la proprotéine convertase 2 dans les cellules des îlots pancréatiques . Dans les cellules L intestinales, le proglucagon est clivé en les produits alternatifs glicentine, GLP-1 (une incrétine), IP-2 et GLP-2 (favorise la croissance intestinale).
Pathologie
Des taux anormalement élevés de glucagon peuvent être causés par des tumeurs pancréatiques, telles que le glucagonome, dont les symptômes comprennent un érythème migratoire nécrolytique, une réduction des acides aminés et une hyperglycémie. Elle peut survenir seule ou dans le cadre d’une néoplasie endocrinienne multiple de type 1.
Un taux élevé de glucagon est le principal contributeur à l’acidocétose hyperglycémique dans le diabète de type 1 non diagnostiqué ou mal traité. Au fur et à mesure que les cellules bêta cessent de fonctionner, l’insuline et le GABA pancréatique ne sont plus présents pour supprimer la sortie libre du glucagon. En conséquence, le glucagon est libéré des cellules alpha au maximum, provoquant une dégradation rapide du glycogène en glucose et une cétogenèse rapide. Il a été constaté qu’un sous-ensemble d’adultes atteints de diabète de type 1 mettait en moyenne 4 fois plus de temps à s’approcher de l’acidocétose lorsqu’ils recevaient de la somatostatine (inhibe la production de glucagon) sans insuline. L’inhibition du glucagon a été une idée populaire du traitement du diabète, cependant, certains ont averti que cela entraînerait un diabète fragile chez les patients ayant une glycémie suffisamment stable.
L’absence de cellules alpha (et donc de glucagon) est considérée comme l’une des principales influences de l’extrême volatilité de la glycémie dans le cadre d’une pancréatectomie totale.
Histoire
Dans les années 1920, Kimball et Murlin ont étudié des extraits pancréatiques et ont découvert une substance supplémentaire aux propriétés hyperglycémiques. Ils ont décrit le glucagon en 1923. La séquence d’acides aminés du glucagon a été décrite à la fin des années 1950. Une compréhension plus complète de son rôle dans la physiologie et la maladie n’a été établie que dans les années 1970, lorsqu’un dosage radio-immunologique spécifique a été développé.
.


















:max_bytes(150000):strip_icc()/when-her-skin-is-irritated-so-is-she-637130254-596d2a42396e5a001123e21a.jpg)
:max_bytes(150000):strip_icc()/200264026-001-56a76c8d3df78cf77295d3b4.jpg)
Discussion about this post