| Virus BK | |
|---|---|
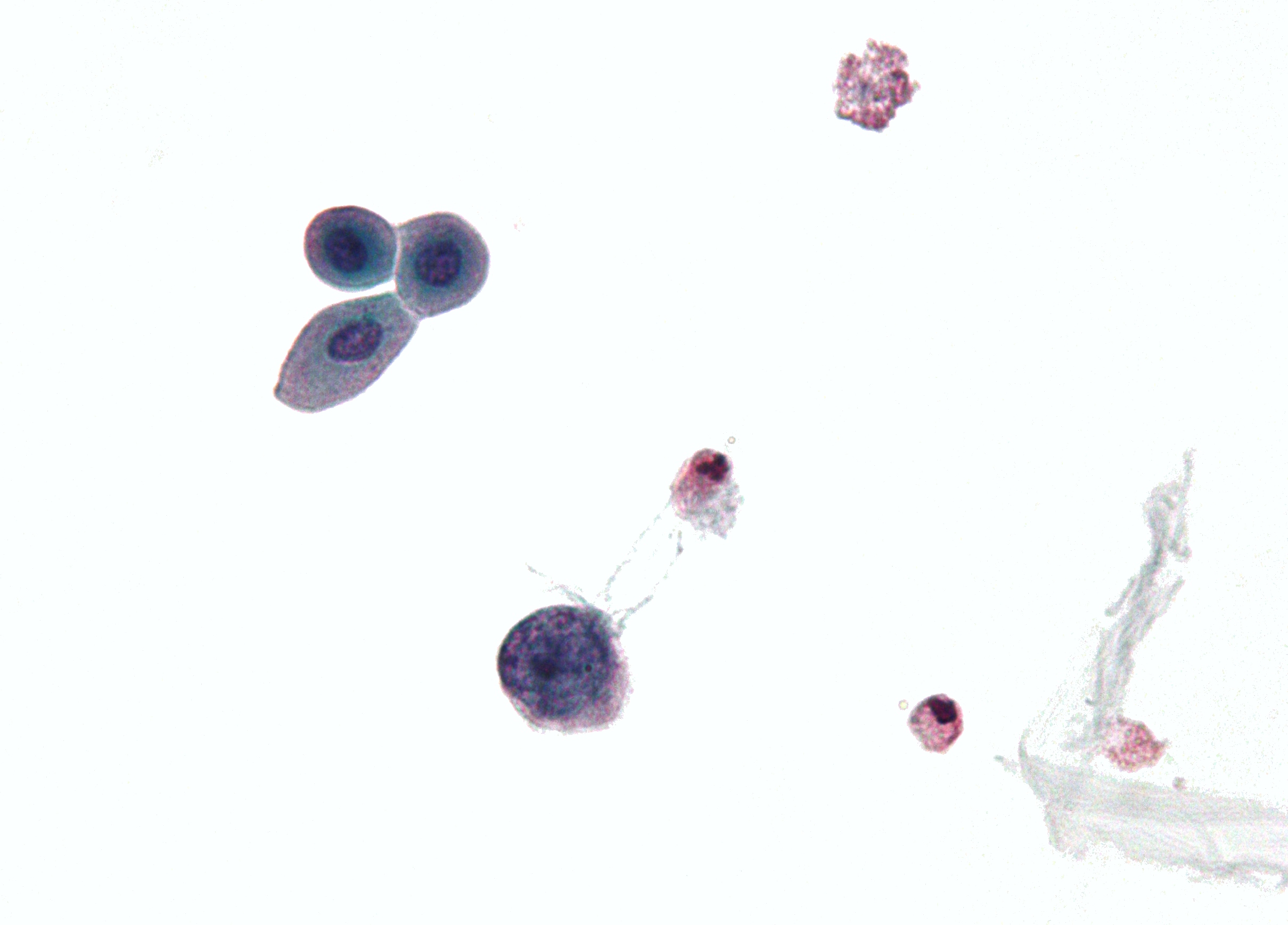 |
|
| Micrographie montrant une cellule infectée par un polyomavirus – grande cellule (bleue) en dessous du centre-gauche. Échantillon de cytologie urinaire. | |
| Spécialité | Maladie infectieuse |
le Virus BK fait partie de la famille des polyomavirus. L’infection par le virus BK est répandue, mais les conséquences significatives de l’infection sont rares, à l’exception des immunodéprimés et des immunodéprimés. Le virus BK est une abréviation du nom du premier patient dont le virus a été isolé en 1971 (le patient avait alors 29 ans).
Symptômes de l’infection par le virus BK
Le virus BK provoque rarement des maladies, mais il est généralement associé à des patients ayant subi une transplantation rénale; de nombreuses personnes infectées par ce virus sont asymptomatiques. Si des symptômes apparaissent, ils ont tendance à être bénins: infection respiratoire ou fièvre. Ce sont des symptômes d’infections BK primaires. Bien que dépourvues de symptômes cliniques, des empreintes de pas du virus BK ont été détectées dans des échantillons de femelles atteintes d’un avortement spontané. Des anticorps sériques contre le virus BK ont également été trouvés chez des femmes affectées par un avortement spontané ainsi que chez des femmes ayant subi une interruption volontaire de grossesse.
Le virus se propage ensuite vers les reins et les voies urinaires où il persiste pendant toute la vie de l’individu. On pense que jusqu’à 80% de la population contient une forme latente de ce virus, qui reste latente jusqu’à ce que le corps subisse une forme d’immunosuppression. En règle générale, cela se produit dans le cadre d’une transplantation rénale ou d’une transplantation multi-organes. La présentation chez ces personnes immunodéprimées est beaucoup plus sévère. Les manifestations cliniques comprennent un dysfonctionnement rénal (observé par une augmentation progressive de la créatinine sérique) et une analyse d’urine anormale révélant des cellules tubulaires rénales et des cellules inflammatoires.
Cause
Transmission du virus
Les médecins ne savent pas comment ce virus se transmet. Mais les médecins savent que le virus se propage d’une personne à l’autre et non d’une source animale. Il a été suggéré que ce virus peut être transmis par les fluides respiratoires ou l’urine, car les personnes infectées excrètent périodiquement le virus dans l’urine. Une enquête menée auprès de 400 donneurs de sang sains a montré que 82% étaient positifs pour les IgG contre le virus BK.
Facteurs de risque
Chez certains patients transplantés rénaux, l’utilisation nécessaire de médicaments immunosuppresseurs a pour effet secondaire de permettre au virus de se répliquer dans la greffe, une maladie appelée néphropathie BK.
De 1 à 10% des patients transplantés rénaux évoluent vers une néphropathie associée au virus BK (BKVAN) et jusqu’à 80% de ces patients perdent leur greffe. L’apparition de la néphrite peut survenir dès plusieurs jours après la transplantation jusqu’à 5 ans.
Elle est également associée à une sténose urétérale et à une néphrite interstitielle. Chez les receveurs de greffe de moelle osseuse, il s’agit d’une cause notable de cystite hémorragique.
Charge de virémie BK> 185 000 copies / ml au moment du premier diagnostic positif de BKV – être le prédicteur le plus fort de BKVAN (97% de spécificité et 75% de sensibilité). De plus, le pic de charge virale du BKV dans le sang atteignant 223 000 copies / ml à tout moment s’est avéré être un facteur prédictif du BKVAN (91% de spécificité et 88% de sensibilité).
Diagnostic de l’infection par le virus BK
Ce virus peut être diagnostiqué par un test sanguin BKV ou un test urinaire pour les cellules leurres, en plus de la réalisation d’une biopsie dans les reins. Des techniques de PCR sont souvent utilisées pour identifier le virus.
Traitement de l’infection par le virus BK
La pierre angulaire du traitement est la réduction de l’immunosuppression. Une récente poussée de BKVAN est en corrélation avec l’utilisation de médicaments immunosuppresseurs puissants, tels que le tacrolimus et le mycophénolate mofétil (MMF). Les études n’ont montré aucune corrélation entre BKVAN et un seul agent immunosuppresseur mais plutôt la charge immunosuppressive globale.
- Il n’existe pas de lignes directrices ou de niveaux et de doses de médicaments pour une réduction appropriée des immunosuppresseurs dans le BKVAN
- Méthodes les plus courantes:
- Arrêt du MMF ou du tacrolimus
- Remplacement du tacrolimus par la cyclosporine
- Réduction globale de la charge immunosuppressive
- Certains taux résiduels de cyclosporine ont été réduits à 100-150 ng / ml et les taux de tacrolimus réduits à 3-5 ng / ml
- L’analyse rétrospective de 67 patients a conclu que la survie du greffon était similaire entre la réduction et l’arrêt des agents.
- Une étude monocentrique a montré que les allogreffes rénales étaient préservées chez 8/8 personnes gérées avec une réduction de l’immunosuppression tandis que la perte de greffe s’est produite chez 8/12 patients traités avec une augmentation du traitement pour ce que l’on pensait être un rejet d’organe.
D’autres options thérapeutiques comprennent le léflunomide, le cidofovir, les IgIV et les fluoroquinolones. Le léflunomide, un inhibiteur de la synthèse de la pyrimidine, est maintenant généralement accepté comme la deuxième option de traitement derrière la réduction de l’immunosuppression.
Léflunomide au BKVAN
La justification de l’utilisation du léflunomide dans BKVAN vient de ses propriétés immunosuppressives et antivirales combinées. Deux études comprenant 26 et 17 patients qui ont développé BKVAN sur un schéma de trois médicaments de tacrolimus, MMF et stéroïdes ont vu leur MMF remplacé par le léflunomide 20 à 60 mg par jour. 84% et 88% des patients avaient respectivement une clairance ou une réduction progressive de la charge virale et une stabilisation ou une amélioration de la fonction du greffon. Dans une étude menée par Teschner et al. en 2009, 12/13 patients dont le MMF a été échangé avec le léflunomide ont éliminé le virus à 109 jours. Dans une série de cas, il y a eu une amélioration ou une stabilisation chez 23/26 patients atteints de BKVAN après le passage du MMF au léflunomide.
Il n’y a pas de directives posologiques pour le léflunomide dans BKVAN. La variabilité d’un patient à l’autre a rendu le dosage et la surveillance du léflunomide extrêmement difficiles.
- L’étude portant sur 26 et 17 patients a reçu des doses comprises entre 20 mg / jour et 60 mg / jour avec des concentrations minimales de 50 à 100 µg / ml. Un échec a été observé chez des patients présentant des taux plasmatiques de léflunomide <40 µg / ml.
- Une étude portant sur 21 patients a révélé que de faibles niveaux (<40 µg / ml) et des niveaux élevés (> 40 µg / ml) avaient des effets similaires sur le taux de clairance virale. Ceux avec des niveaux plus élevés ont eu plus d’événements indésirables (hématologiques, hépatiques).
- Dans l’étude de Teschner et al., Les dosages et la concentration du médicament n’ont montré aucune corrélation avec une variation substantielle d’une personne à l’autre.
- Dans l’étude Teschner, de faibles concentrations de médicament étaient associées à une diminution de la charge virale. Cela rend difficile de déterminer si la réduction de la charge virale ou l’ajout de léflunomide était la cause de la clairance virale.
Autres options de traitement
- Antibiotiques quinolones: il a été démontré que la ciprofloxacine (Cipro) réduisait considérablement la charge virale, mais aucune donnée sur la survie et la perte de greffe n’existe.
- L’immunoglobuline intraveineuse (IVIG) est utilisée dans le traitement de l’infection et du rejet d’allogreffe – difficile à distinguer
- Le cidofovir a des données limitées et est hautement néphrotoxique.
Histoire
Le virus BK a été isolé pour la première fois en 1971 à partir de l’urine d’un patient transplanté rénal, initiales BK Le virus BK est similaire à un autre virus appelé virus JC (JCV), puisque leurs génomes partagent une similarité de séquence de 75%. Ces deux virus peuvent être identifiés et différenciés l’un de l’autre en effectuant des tests sérologiques à l’aide d’anticorps spécifiques ou en utilisant une approche de génotypage basée sur la PCR.
.



















Discussion about this post